Janssen pede autorização para uso emergencial de vacina à Anvisa
Em nota, a agência informou que já iniciou a triagem dos documentos presentes no pedido
A Janssen, braço farmacêutico da Johnson & Johnson, solicitou à Anvisa (Agência Nacional de Vigilância Sanitária), às 19h desta quarta-feira (24), o uso emergencial do seu imunizante no país. Em nota, a agência informou que já iniciou a triagem dos documentos presentes no pedido.
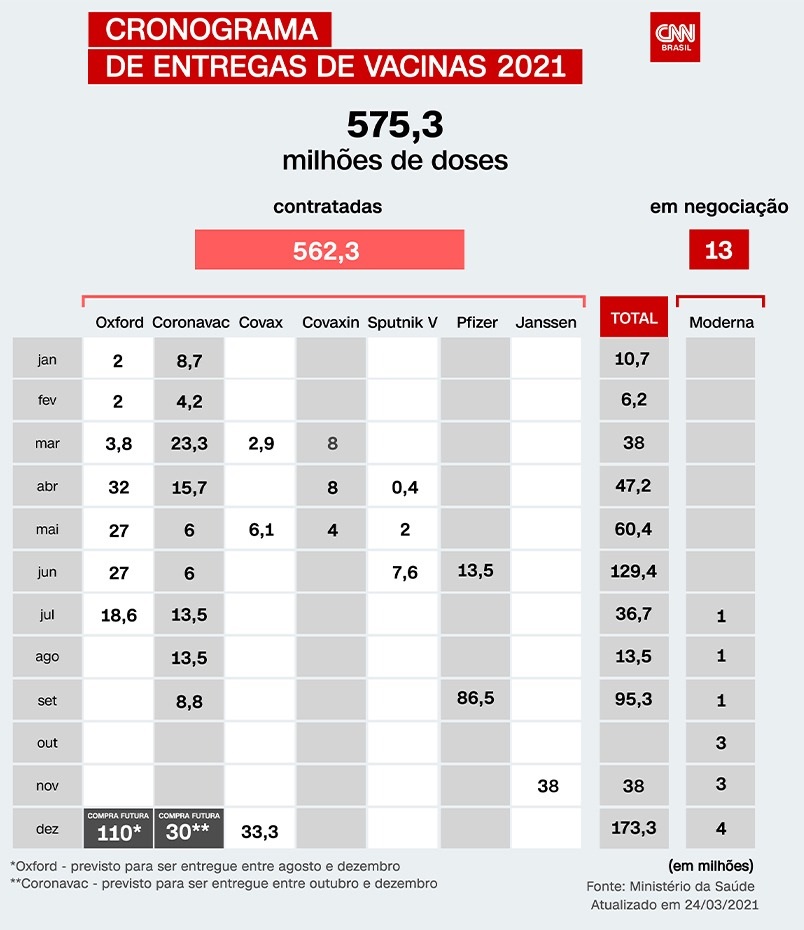
Apesar de ainda não ter seu uso aprovado no Brasil, a vacina da farmacêutica aparece no Plano Nacional de Imunizações (PNI) do Ministério da Saúde. De acordo com a pasta, 38 milhões de doses do imunizante devem ser entregues até o final de novembro.
Diferente dos outros imunizantes aprovados para uso atualmente no Brasil – Coronavac, Pfizer e Oxford/AstraZeneca -, a vacina fabricada pela Janssen precisa apenas de uma dose para imunizar uma pessoa contra a Covid-19.
O acordo assinado pelo governo brasileiro com a Janssen prevê a entrega de 38 milhões de doses do imunizante de dose única no último trimestre de 2021 ao custo de US$ 10 (R$ 5,62 na cotação desta quarta-feira) por dose. Os dados constam no documento assinado com a empresa ao qual o âncora da CNN Kenzô Machida teve acesso.

Processo do pedido
De acordo com a Anvisa, nas próximas 24 horas será feita uma triagem no processo, para verificar se os documentos necessários foram disponibilizados pela empresa. Caso falte alguma informação importante, a agência pode solicitar as informações adicionais ao laboratório.
A agência informou também que o prazo de sete dias úteis previsto para a análise do pedido não considera o tempo do processo “em status de exigência técnica”, que é quando o laboratório precisa responder questões técnicas feitas pela Anvisa dentro do processo.
Em sua análise a Anvisa utilizará agora as informações apresentadas junto com o pedido e as já analisadas no processo de submissão contínua.
Uma equipe com especialistas das áreas de registro, monitoramento e inspeção fará a análise do pedido e tem até sete dias úteis – descontando o tempo em que o processo possa ficar pendente de informações – para concluir o estudo.