Anvisa autoriza uso emergencial da vacina da Janssen contra Covid-19
Vacina do braço farmacêutico da Johnson & Johnson é a primeira em dose única aprovada para uso no Brasil; Ministério da Saúde comprou 38 milhões de doses
Por unanimidade, a Agência Nacional de Vigilância Sanitária (Anvisa) autorizou nesta quarta-feira (31) o uso emergencial da vacina da Janssen, braço farmacêutico da Johnson & Johnson, contra o novo coronavírus.
Todos os cinco membros da Diretoria Colegiada, incluindo o diretor-presidente da Anvisa, Antonio Barra Torres, se manifestaram a favor do uso temporário do imunizante, garantindo a liberação do uso emergencial. Eram necessários, ao menos, três votos favoráveis para aprovar o pedido.
A Janssen havia solicitado o uso emergencial de seu imunizante contra a Covid-19 no Brasil na quarta-feira (24). Com a decisão da agência, a vacina pode agora ser aplicada na população brasileira.
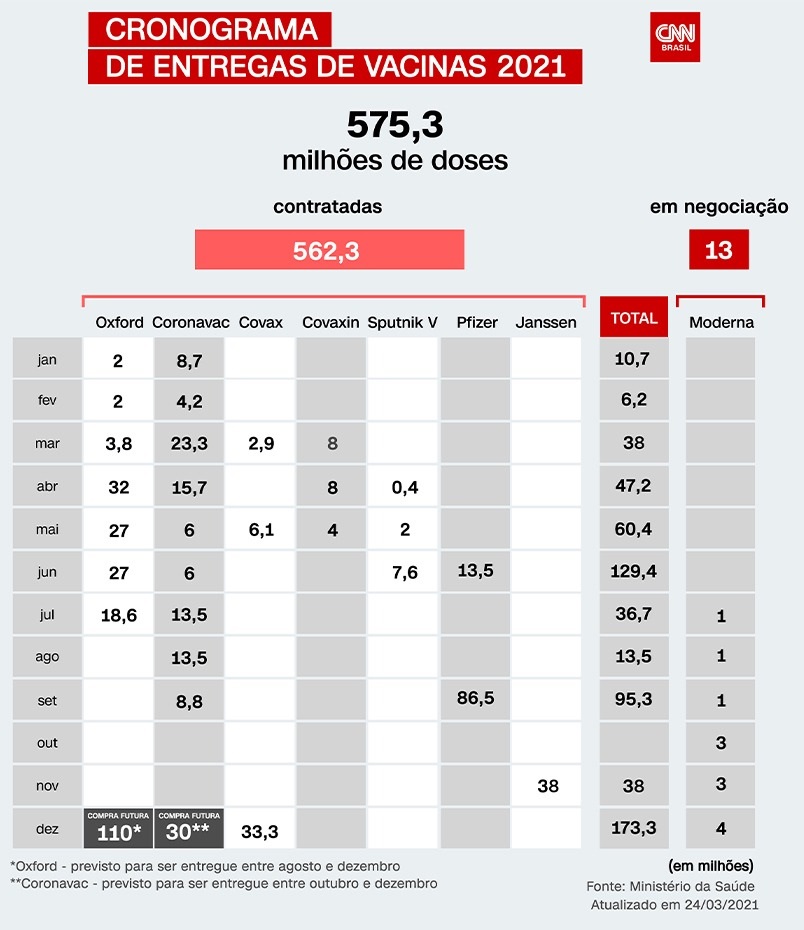
A entrega de 38 milhões de doses do imunizante, que faz parte do Plano Nacional de Imunizações (PNI) do Ministério da Saúde, deve começar em julho – até setembro, devem ser entregues 16,9 milhões de doses; depois, de outubro a dezembro, são esperadas mais 21,1 milhões de doses.
A diretora da Anvisa Meiruze Souza Freitas, relatora do pedido, foi a primeira a se manifestar depois da área técnica da agência. Ela endossou os pareceres anteriores e deu voto favorável à aprovação do uso emergencial temporário do imunizante.
Freitas ressaltou que a vacina da Janssen já foi aprovada para uso emergencial pela FDA, dos Estados Unidos, pela agência canadense de medicamentos, pela Agência Europeia de Medicamentos (EMA) e pela Organização Mundial da Saúde (OMS).
“Dada a atual situação de emergência, considera-se que as incertezas podem ser resolvidas por meio de obrigações específicas, incluindo a continuação do estudo clínico principal pelo maior tempo possível, estudo de eficácia após aprovação e vigilância de rotina de segurança”, afirmou a diretora.
“Essa relatoria conclui que os especialistas da Anvisa avaliaram que a vacina atende as expectativas dessa agência quanto as requisitos de qualidade, segurança e eficácia para autorização dessa vacina no contexto do uso emergencial”, continuou.
“Pelo exposto, voto pela aprovação da autorização temporária da vacina Janssen Covid-19, condicionada a assinatura de termo de compromisso e subsequente publicação de seu extrato em Diário Oficial.”
Recomendação da área técnica da Anvisa
Primeiro a se manifestar na reunião, Gustavo Mendes Lima Santos, gerente-geral de medicamentos e produtos biológicos da agência, recomendou a aprovação para uso emergencial da vacina por demonstrar “eficácia da dose única em pacientes adultos maiores de 18 anos”.
“Com base nos resultados dos estudos, é possível estabelecer um prazo de 3 meses de estabilidade do produto quando conservado em temperaturas de 2ºC a 8ºC. Recomendamos não congelar e proteger da luz porque o adenovírus é sensível e, após aberta, a vacina pode ser usada por até 6 horas, desde que armazenada entre 2ºC a 8ºC”, afirmou.
Ele afirmou que a Anvisa não observou efeitos colaterais que possam causar questões graves em razão do uso do imunizante, mas ressaltou algumas incertezas em relação ao imunizante, incluindo ausência de dados sobre uso concomitante com outras vacinas, o não estabelecimento da eficácia e segurança de longo prazo e a incerteza sobre a eficácia da vacina contra as novas variantes do novo coronavírus.
O uso do imunizante também foi recomendado pela área de Inspeção e Fiscalização Sanitária da Anvisa.
“Com base nos dados apresentados, a conclusão é que a documentação apresentada, em conjunto com todas certificações já concedidas, atendem ao determinado (…) pela Anvisa e sugere cumprimento das boas práticas que justificam o uso emergencial da vacina no atual cenário pandêmico”, afirmou Ana Carolina Moreira Marino Araújo, gerente-geral da área.
Ela afirmou que, no caso da vacina da Janssen, foram validadas 8 plantas no processo de fabricação do imunizante e que a eventual inclusão de novos locais deveria ser objeto de novo pedido de uso emergencial por parte da empresa.
Suzi Teixeira Gomes, gerente-geral de monitoramento de produtos sujeitos a Vigilância Sanitária da Anvisa, destacou que o plano de gerenciamento de risco apresentado pela Janssen-Cilag se apresenta em conformidade e parecem compatíveis com o produto apresentado até o momento.
“Uma etapa muito importante está nos estudos de segurança após autorização, que é um dos mecanismos para reduzir as incertezas já apontadas, incluindo tempo de prevenção, uso em populações específicas, interações com outros medicamentos”, apontou.










