Anvisa autoriza por unanimidade o uso de autotestes de Covid-19 no Brasil
Decisão foi divulgada nesta sexta-feira (28), após votação da Diretoria Colegiada da agência a partir de análise de informações complementares enviadas pelo Ministério da Saúde
A Agência Nacional de Vigilância Sanitária (Anvisa) autorizou o uso de autotestes de Covid-19 no Brasil. A decisão aconteceu nessa sexta-feira (28), após votação da Diretoria Colegiada da agência a partir da análise da solicitação e envio de informações complementares pelo Ministério da Saúde.
Autorização permite a comercialização dos testes em farmácias e estabelecimentos de saúde. Os exames, que podem ser feitos em casa, permitem realizar o acompanhamento das condições da doença. No entanto, os testes não são conclusivos para o diagnóstico segundo a Anvisa.
Na abertura da reunião, transmitida ao vivo pelas redes sociais da Anvisa, a diretora Meiruze Sousa Freitas destacou que o diretor-presidente Antônio Barra Torres não participou do evento por questões de saúde na família.
Votaram a favor os diretores Meiruze Sousa Freitas, Cristiane Rose, Romison Rodrigues Mota e Alex Machado Campos. A decisão, que acontece por maioria simples dos votos, foi tomada por unanimidade.
Destaques da votação
Durante a votação, os diretores destacaram os aspectos principais que levaram à autorização pela agência.
A diretora Cristiane Rose Jourdan destacou o contexto do aumento significativo de casos da doença no país devido ao avanço da variante Ômicron do novo coronavírus, altamente contagiosa.
“O produto de diagnóstico in vitro na forma de autoteste pode representar excelente estratégia de triagem e medida adicional no controle da pandemia, principalmente nesse momento em que o contágio pela doença é grande e muitas pessoas não conseguem ter acesso aos testes pelo SUS ou por laboratórios na rede privada”, disse Cristiane.
O diretor Rômison Rodrigues Mota destacou que os autotestes podem contribuir para reduzir a disseminação do novo coronavírus.
“Ao possibilitar o registro de dispositivos médicos para diagnóstico in vitro para detecção do antígeno do SARS-CoV-2 como autoteste cumpre a finalidade institucional desta Anvisa, uma vez que abre possibilidade de ampliar o acesso da sociedade a testes que permitam a rápida detecção do vírus”, disse.
A opinião foi compartilhada pelo diretor Alex Machado Campos. “O papel dos autotestes nesse momento, com a participação e o envolvimento direto do cidadão pode contribuir, não há dúvida, significativamente para que nós possamos quebrar cadeias de transmissão”, afirmou.
A diretora Meiruze Sousa Freitas ressaltou que, para que os testes sejam comercializados, as empresas devem realizar o pedido de registro junto à Anvisa. A liberação acontecerá após a avaliação da agência de características como segurança e precisão dos exames.
“Com a aprovação dessa regulamentação, não significa que o autoteste vai estar disponível hoje ou amanhã em um estabelecimento autorizado à sua comercialização. É preciso que uma empresa regularizada venha à Anvisa e registre o seu autoteste”, disse Meiruze.
Entenda o processo
O Ministério da Saúde enviou uma solicitação à Anvisa para autorização do uso de autoteste para Covid-19 no dia 13 de janeiro. No parecer enviado à Anvisa, o ministério afirmou que a aprovação é uma estratégia complementar ao Plano Nacional de Expansão da Testagem, política pública lançada pela pasta em setembro.
“Os TR-Ag para a detecção do SARS-CoV-2 fazem parte de uma política de saúde pública consolidada pelo MS, de forma que o autoteste deverá ser utilizado de forma complementar, como estratégia de triagem”, diz o documento encaminhado à Anvisa.
No entanto, a Diretoria Colegiada da Anvisa votou, em maioria, no dia 19, pela cobrança de informações adicionais, por parte do Ministério da Saúde, de política pública para uso dos exames no país.
De acordo com as regras vigentes da Anvisa, o registro de autoteste de doenças infectocontagiosas de notificação compulsória, como a Covid-19, só podem ser feitos caso haja uma política de saúde pública e estratégia de ação estabelecidas pelo Ministério da Saúde.
No dia 21, técnicos da Anvisa se reuniram com o Ministério da Saúde para discutir a implementação dos autotestes no país. De acordo com a Anvisa, na reunião “foram debatidos detalhes necessários para a implantação do autoteste, buscando o preenchimento de possíveis lacunas na construção da proposta”.
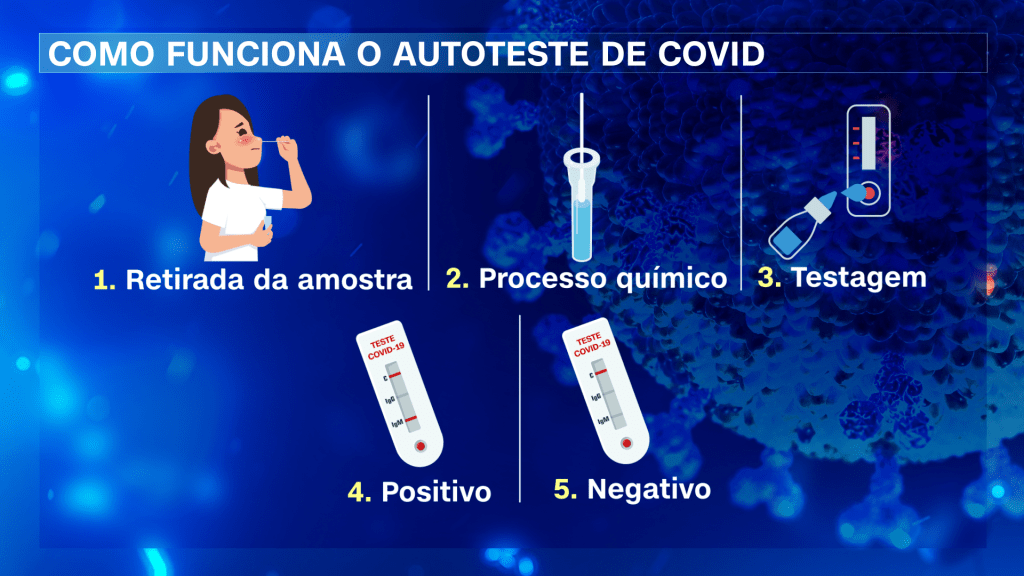
Como funcionam os autotestes
O neurocirurgião e neurocientista Fernando Gomes, do Hospital das Clínicas de São Paulo, explica que a autotestagem é uma metodologia comum na medicina, como a medição de glicose no sangue para pacientes com diabetes ou testes de HIV e de gravidez. “Não é nada muito novo quando falamos em aplicação para a população em larga escala”, disse.
No caso do coronavírus, o paciente que possui o kit realiza a coleta através da secreção do nariz ou da boca com um cotonete. Na sequência, a haste é introduzida em um processo químico e colocada para a testagem. O resultado está disponível em cerca de meia hora, indicando tanto o resultado positivo quanto negativo para a presença do vírus.
Os detalhes sobre a utilização dos exames podem ser conferidos no quadro Correspondente Médico, do jornal Novo Dia.
“Existe uma segurança biológica, existem trabalhos científicos mostrando a eficiência do teste, mas é lógico que existe a variação humana. Obviamente, até agora, isso tem sido feito por profissionais da saúde treinados. Mas a autotestagem pode, sim, ajudar a um comportamento ativo em termos de segurar uma pessoa que esteja assintomática para que ela não passe a doença para outras pessoas”, afirmou Gomes.
A pesquisadora Chrystina Barros, da Universidade Federal do Rio de Janeiro (UFRJ), afirma que as diferentes especificações técnicas de cada kit de diagnóstico precisam estar disponíveis em linguagem simples e acessível.
“Todas essas observações precisam ser feitas pelo fabricante de acordo com cada kit. Isso precisa estar validado pela vigilância sanitária para se garantir que o produto que está sendo colocado no mercado atende às especificações técnicas, a segurança da coleta e do resultado no que é possível de se alcançar nesse tipo de exame”, disse.
O autoteste é utilizado como estratégia de saúde pública nos Estados Unidos e em países da Europa, como Reino Unido, Portugal e Itália.
Ampliação da testagem no país
Desde o início da pandemia de Covid-19, em março de 2020, a testagem tem sido apontada por epidemiologistas como uma estratégia fundamental para o enfrentamento da doença.
A partir do diagnóstico e do tratamento adequado dos pacientes, é possível orientar o distanciamento social e promover o rastreamento de outras pessoas que podem ter sido expostas à infecção.
Para o pesquisador Cláudio Maierovitch, da Fundação Oswaldo Cruz (Fiocruz), em Brasília, a utilização do autoteste, como estratégia de saúde pública, poderá trazer benefícios para o contexto epidemiológico da doença no país.
“Nós poderíamos ter um instrumento colocado pelo governo, de forma gratuita, à disposição de públicos prioritários, para que isso facilitasse a identificação de pessoas com o vírus, e fossem praticadas as medidas de isolamento, quarentena e controle. Isso poderia dar mais segurança para a volta às aulas nas escolas públicas, por exemplo”, afirma.
Confira orientações do Ministério da Saúde diante do diagnóstico positivo de Covid-19
[cnn_galeria active=”false” id_galeria=”637570″ title_galeria=”Confira orientações do Ministério da Saúde diante do diagnóstico de Covid-19″/]
(Com informações de Fabrizio Neitzke, Larissa Rodrigues, Anna Gabriela Costa, Douglas Porto, Layane Serrano, Gustavo Uribe e Renata Souza, da CNN)










