Farmacêutica pede autorização da Anvisa para fase 3 de testes da Sputnik
Com uma resposta positiva da agência para a realização da pesquisa no país, empresa pretende ingressar com o pedido de registro de uso emergencial da vacina


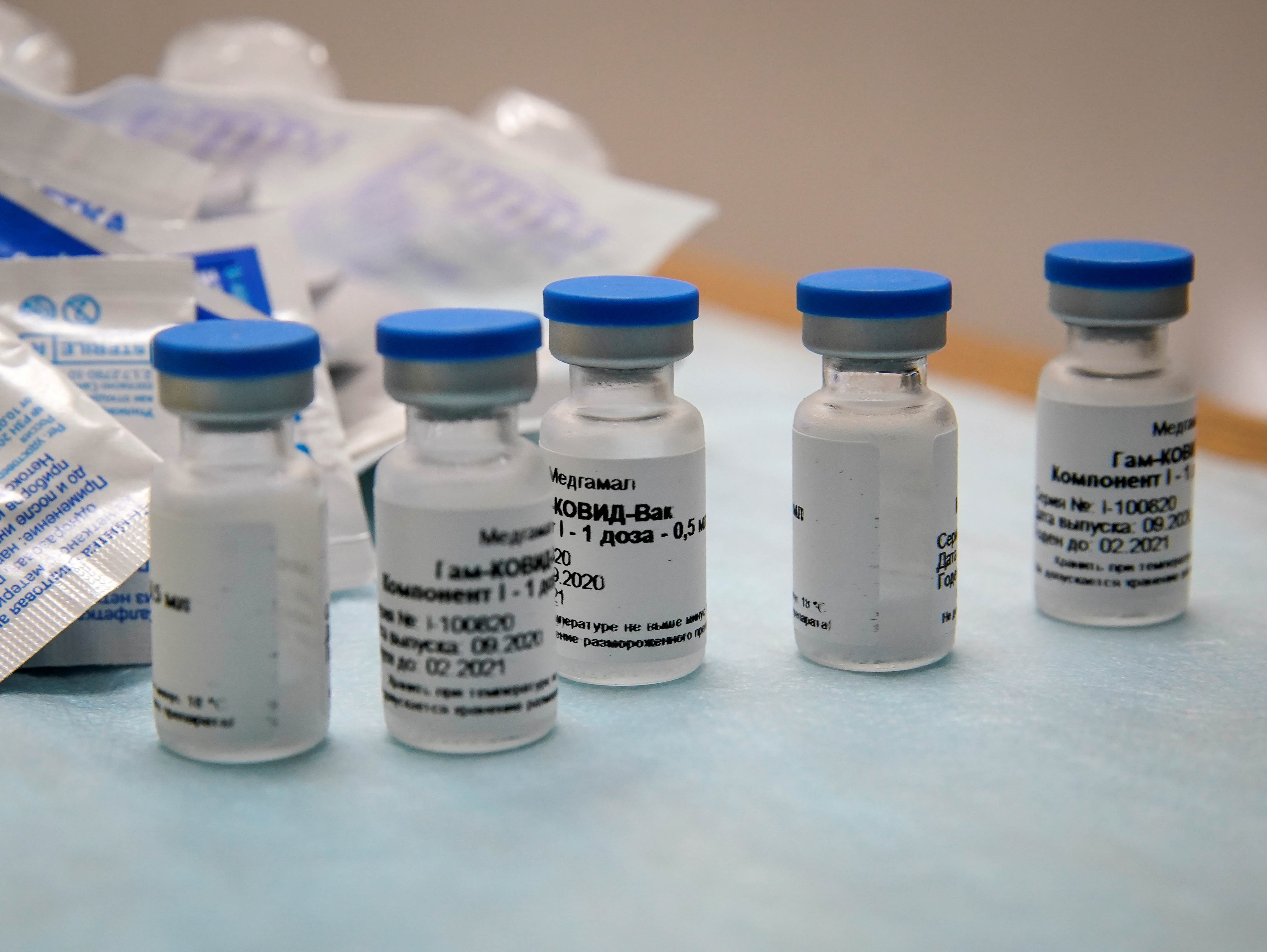
A companhia brasileira União Química, responsável pela produção da vacina russa contra a Covid-19 na América Latina, apresentou à Anvisa (Agência Nacional de Vigilância Sanitária), na noite desta terça-feira (29), um pedido para dar início à fase 3 de testes clínicos no Brasil. A informação foi confirmada pela agência.
A CNN apurou que, com uma resposta positiva da agência para a realização da pesquisa no país, a União Química pretende ingressar com o pedido de registro de uso emergencial da vacina no Brasil.
A solicitação formal à Anvisa para a terceira fase de testes clínicos também é assinada pelo Fundo de Investimentos Diretos da Rússia (RDIF), que financia a produção da Sputnik V. Segundo informações da União Química, a produção da Sputnik V no Brasil terá início em janeiro, por intermédio de transferência de tecnologia, nas unidades da farmacêutica em Brasília e em Guarulhos, na Grande São Paulo.
Leia também:
Quais países já começaram a vacinação contra a Covid-19 e quais são os próximos
Como o mundo conseguiu uma vacina em menos de 1 ano
Em nota, a Anvisa informou que, com a entrada do pedido, a agência vai analisar o protocolo de pesquisa em até 72 horas.
“O pedido se refere à realização de pesquisa clínica, que é a pesquisa com seres humanos. A autorização da Anvisa é obrigatória para pesquisas que tenham como foco o futuro registro de uma vacina ou medicamento”, diz a nota da Anvisa.
A agência também afirmou que, nas últimas semanas, realizou uma série de reuniões com o laboratório “para orientar e trocar informações sobre a formatação do pedido de estudo e conhecer a proposta de estudo”.
Ainda segundo a Anvisa, as informações sobre número de voluntários e locais em que a vacina Sputinik V será testada estão nos documentos apresentados pelo farmacêutica e ainda serão analisadas pelos técnicos da agência.
À CNN, Rogério Rosso, diretor de negócios internacionais da União Química, afirmou que a farmacêutica está “fazendo todos os esforços industriais, tecnológicos e logísticos para disponibilizar o quanto antes a maior quantidade de doses para o Brasil”. “A Anvisa é nosso guia e estamos cumprindo estritamente todas as etapas”, disse.
Nesta terça-feira, a Argentina deu início à imunização de sua população com a vacina russa. Na quinta-feira (24), o país recebeu 300 mil doses da Sputnik V. Além de atingir um percentual reduzido da população (0,6% dos quase 45 milhões de argentinos), o carregamento também não se resolve em si.
A Sputnik V é composta de duas injeções, que possuem conteúdos distintos.
Também hoje, Belarus passou a usar em sua população a vacina. O país espera vacinar cerca de 200 mil pessoas com a Sputnik V na primeira fase de seu programa nacional, disse o ministro da Saúde, Dmitry Pinevich, na semana passada.
Anvisa muda regras para uso emergencial de vacinas
Na última segunda-feira, o presidente Jair Bolsonaro (sem partido) voltou a cobrar os laboratórios produtores da vacina contra a Covid-19 a procurarem a Anvisa para buscar a aprovação do imunizante no Brasil.
Nesta terça-feira, a Agência Nacional de Vigilância Sanitária (Anvisa) divulgou uma nova versão das regras para a autorização emergencial de vacinas contra a Covid-19.
A Anvisa simplificou o trecho que exigia um cronograma de disponibilização de doses e se fiou ao Reino Unido no trecho que trata do termo de consentimento a ser assinado em caso de imunização dentro do uso emergencial de vacinas.
As alterações abarcam os itens XVI e XIX do guia divulgado pela Anvisa. No item XVI, interessados passam apenas a precisar dizer quantas doses podem fornecer ao Brasil, sem estipular já no momento do protocolo um cronograma de disponibilização.
Destaques da CNN Brasil Business:
Ibovespa anda de lado, após superar recorde histórico; dólar recua
6 atitudes para avançar na carreira em 2021
Mega da Virada: veja os números mais e menos sorteados na Mega-Sena em 2020
Já no item XIX, que trata do termo de consentimento para a vacinação emergencial, a Anvisa passa a estipular o termo utilizado no Reino Unido como modelo para interessados no registro. O termo é um modelo simples, de apenas uma página e poucos campos a serem preenchidos.










