Vacina da Janssen terá de apresentar eficácia contra cepa brasileira, diz Anvisa
Gerente-geral de medicamentos da agência falou à CNN sobre a aprovação para uso emergencial do imunizante
O gerente-geral de medicamentos da Anvisa (Agência Nacional de Vigilância Sanitária), Gustavo Mendes, afirmou nesta quarta-feira (31), em entrevista à CNN, que a vacina da Janssen, que foi autorizada para uso emergencial no país, terá que ser estudada para saber se é eficaz contra a variante brasileira da Covid-19.
“O ponto das variantes é uma incerteza. Estamos cobrando dos desenvolvedores das vacinas no Brasil dados que mostrem uma eficácia mínima a essas variantes para que possamos indicar em bula. A Anvisa não recebeu dados que mostrem essa indicação. Os estudos estão em andamento, colocamos no termo de compromisso que a Janssen investigue o desempenho frente à variante brasileira”, afirmou à CNN.
A Janssen havia solicitado o uso emergencial de seu imunizante contra a Covid-19 no Brasil na quarta-feira (24). Com a decisão da agência, a vacina pode agora ser aplicada na população brasileira.
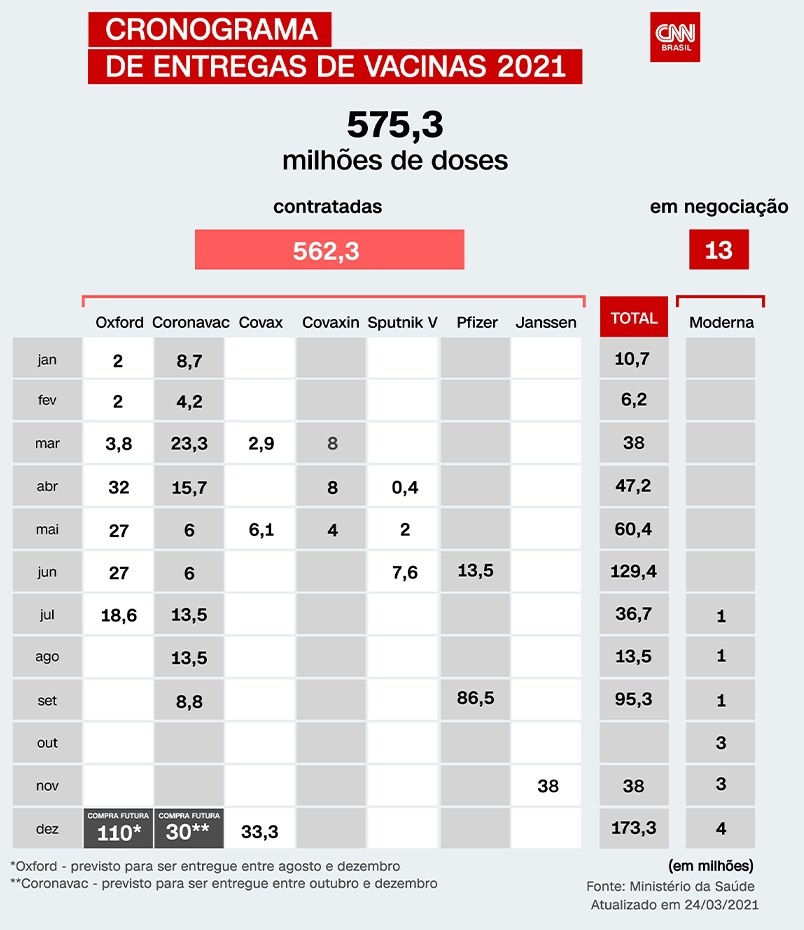
A entrega de 38 milhões de doses do imunizante, que faz parte do Plano Nacional de Imunizações (PNI) do Ministério da Saúde, deve começar em julho – até setembro, devem ser entregues 16,9 milhões de doses; depois, de outubro a dezembro, são esperadas mais 21,1 milhões de doses.
Segundo Mendes, além das pesquisas sobre a eficácia contra a variante brasileira da Covid-19, a empresa terá que mostrar a comparação do desempenho das doses produzidas em diferentes locais. “Já temos o modelo do estudo dessa comparabilidade, que vai ser apresentado em curto prazo, antes da disponibilização para uso no Brasil”, disse.

Primeiro a se manifestar na reunião que terminou com a aprovação do uso do imunizante, Mendes recomendou na ocasião o uso emergencial da vacina, por demonstrar “eficácia da dose única em pacientes adultos maiores de 18 anos”.
Na ocasião, ele afirmou também que a Anvisa não observou efeitos colaterais que possam causar questões graves em razão do uso do imunizante, mas ressaltou algumas incertezas em relação a ela, incluindo ausência de dados sobre uso concomitante com outras vacinas, o não estabelecimento da eficácia e segurança de longo prazo e a incerteza sobre a eficácia da vacina contra as novas variantes do novo coronavírus.
À CNN, o gerente da Anvisa afirmou que, embora a vacina possa ser guardada em geladeira, é preciso ficar atento aos prazos para uso. “Pelos estudos apresentados pela empresa, é um tempo muito curto: são três meses com vidro fechado e, quando aberto, seis horas. Vai ter que ter uma preocupação de quem aplica para cumprir esse tempo”, alertou.
Covaxin
Mendes falou ainda sobre a Covaxin, que teve a aprovação para importação negada depois de também não obter o certificado de boas práticas da agência.
Todos os cinco diretores da agência deram voto contrário ao pedido de importação do imunizante, que consta no Plano Nacional de Imunizações (PNI) do Ministério da Saúde, que espera receber 20 milhões de doses da vacina até o final de maio.
“Fomos na fábrica, inspecionamos as instalações e tinham alguns pontos críticos. Por exemplo, o fato de que, por ser uma vacina com vírus inativado, o processo tem que ser muito transparente e bem controlado para ter certeza da inativação, pois, caso contrário, pode causar mal. Isso pesou na decisão de hoje. A empresa terá tempo para se adequar”.










